年齢依存的オルタナティブ・スプライシング (ADAS) による細胞の若年性の実現
私たちの研究室では、小児難病の病態を明らかにし、治療法を開発することを目的に研究をおこなっています。

その目的に向けて、子どもには、大人にはないいくつもの強みがあることに着目しました。子どもは体は小さくて弱いのですが、豊かな再生能力をもち、高い学習能力があり、体を成長させることができます。そのような強みを「若年特性」(または小児特性)と呼んでいます (図1)。
子どもが生まれつき備えている若年特性を病気の治療に役立てられる可能性がありますが、この特性を実現させている仕組みは、よくわかっていません。
私たちは動物モデルを使った研究を行い、子どもの成長期に強く働いている遺伝子を調べ、「若年性遺伝子」として発表しました (下記、文献1)。若年性遺伝子がどのような役割を担っているかを調べた結果、その1つは、細胞の若さ (「細胞若年性」、 “cellular juvenescence”) を保つことであると考えられました (文献2)。しかし、若年性遺伝子がどのようにして細胞の若さを保っているのか、よくわかっていませんでした。
今回発表した論文では、スプライシングと呼ばれる機構により、若年性遺伝子が細胞の若さを実現していることを発表しました。
スプライシングとは、遺伝子の機能を増やす機構です。遺伝子は細胞の核にあるゲノムDNAに4つの文字 (A,C,G,T) の並びで書かれています。DNA情報はRNAに写し取られ (転写と呼ばれます)、RNAを鋳型として蛋白質の合成 (翻訳と呼ばれます) が行われます。蛋白質はたとえば酵素としての機能をもっています。この仕組みにより、生命は4つの文字で書かれた遺伝情報をもとに、生命活動をおこなっています。スプライシングは、RNAから必要な部分(エキソン)を残して不必要な部分(イントロン)を捨て去り、必要な部分をつなぎ合わせる機構です (図2)。特筆すべきことに、スプライシングによる不要な部分の選択には何通りもの違ったやり方があり、「オルタナティブ・スプライシング」と呼ばれます。オルタナティブ・スプライシングが起こると、同じ1つの遺伝子から、何通りものRNA (ひいては蛋白質) が作られることになります (図2)。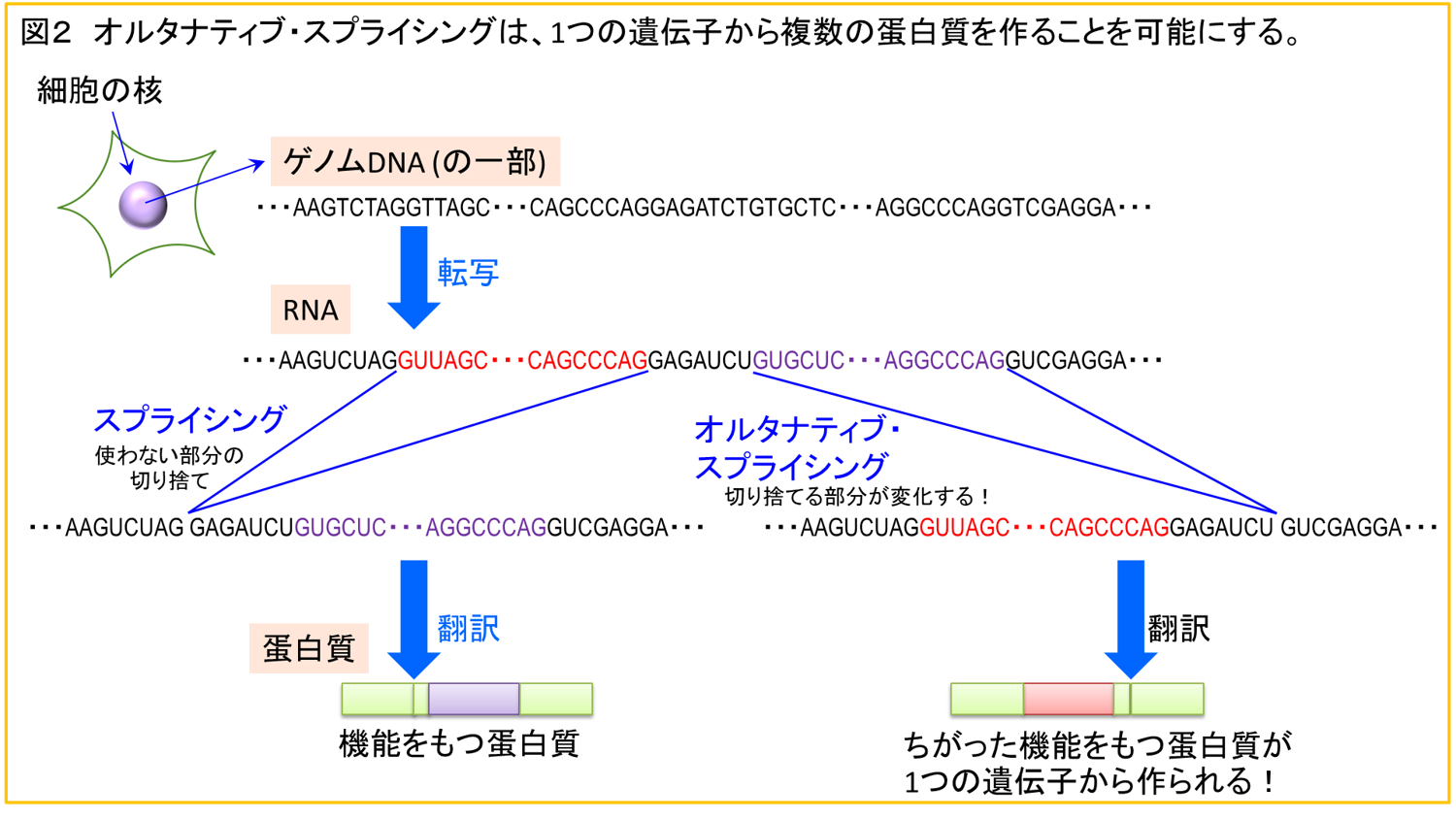
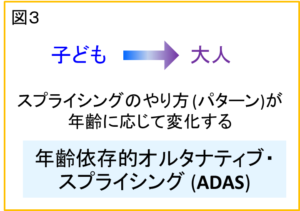
私たちが立てた仮説は、子どもと大人とでは、この「オルタナティブ・スプライシング」によって、同じ遺伝子でも、違ったRNAができているのではないかというものでした。マウスを使った実験の結果、実際に、オルタナティブ・スプライシングにより子どもでは大人と違ったスプライシングのやり方が非常に広く起きていることがわかりました。私たちは、この子ども特有のスプライシングを、年齢依存的オルタナティブ・スプライシング (英語ではage-dependent alternative splicing, 略してADAS“エイダス”) と名付けました (文献3) (図3)。
では、どのようにしてADASは若年特性をもたらしているのでしょうか? 詳細に調べた結果、ADASによって子どもと大人とでスプライシングが変化している遺伝子には、「同化反応」にかかわるものが多いことがわかりました。同化反応とは、食事などによって体に取り入れた栄養分 (糖、蛋白質、脂質など) を、自分の体 (骨、筋肉、内臓など) に作り上げることです。
例えばEIF4A2という分子は、大人では蛋白質の合成 (翻訳) を阻害します。ところが、ADASによってスプライシングが変化したEIF4A2は、阻害するための部位が失われて短くなっています。この結果、子どもで働いているEIF4A2分子は、蛋白質の合成を阻害することができないと考えられます。子どもでは成長するために蛋白質をたくさん作りますが、大人は成長はおきません。EIF4A2が短くなり、子どもの体では蛋白質づくりを邪魔しないようになっていることが、小児期の成長を裏付ける仕組みの1つになっているのではと私たちは考えています (図4)。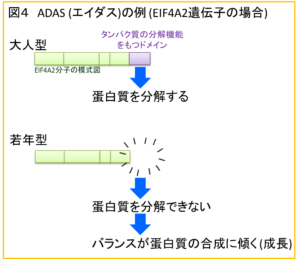
小児の難病を見据えると、私たちの研究結果は、小児のやり方のオルタナティブ・スプライシングを優位にすることで、体の成長機能 (または再生機能) を促進するという可能性を示唆します。私たちの研究は今後、より詳細な分子機構を明らかにし、疾患を治療する可能性の直接的な検証に進んで行く必要があります。
文献1: Faidruz Azura Jam#, Yosuke Kadota#, Anarmaa Mendsaikhan#, Masaki Mori. (#, equally contributing authors)
“Identification of juvenility-associated genes in the mouse hepatocytes and cardiomyocytes”
Scientific Reports, 8, 3132, doi:10.1038/s41598-018-21445-3, 2018
文献2: Ayami Tano#, Yosuke Kadota#, Takao Morimune#, Faidruz Azura Jam, Haruka Yukiue, Jean-Pierre Bellier, Tatsuyuki Sokoda, Yoshihiro Maruo, Masaki Mori. (#, equally contributing authors)
“Juvenility-associated lncRNA Gm14230 maintains cellular juvenescence”
Journal of Cell Science, doi: 10.1242/jcs.227801, 2019
文献3: Yosuke Kadota#, Faidruz Azura Jam#, Haruka Yukiue#, Ichiro Terakado, Takao Morimune, Ayami Tano, Yuya Tanaka, Sayumi Akahane, Mayu Fukumura, Masaki Mori. (#, equally contributing authors)
“Srsf7 establishes the juvenile transcriptome through age-dependent alternative splicing in mice”
iScience, 22;23(3):100929. doi: 10.1016/j.isci.2020.100929, 2020
