若年性 Juvenility
なぜ子どもは大人と違い、同じように食事を摂っても、体を大きく成長させたり体のはたらきを向上させることに使えるのでしょうか? 大人では摂り過ぎた栄養は、熱になって燃えてしまうか脂肪組織に沈着します。子どもでは、体をつくる分子や機能など高次の情報に変換されて利用されます。つまり、同じ栄養源から定常状態よりも高次の構造や機能をもつ分子に転換するロジックが小児には備わっていますが、その実体は明らかになっていません。その仕組みは大人になると失われますが、その機序もわかっていません。
そのような小児に特有のポテンシャルを「若年性」、英語では"Juvenility"と呼んで研究対象としています。
若年性の分子ロジックを明らかにするため、成長段階にある小児期に高発現していて大人になると発現が低下する遺伝子を網羅同定しました。これらの遺伝子の中に、小児期に特有の成長・成熟ポテンシャルを構成している分子が含まれるはずです。そのような小児期に限って高発現する遺伝子を「若年性遺伝子 (juvenility-associated genes, JAG)」として同定しました。各臓器でおよそ1,000種類の遺伝子が小児期に高発現しています。その中にはほとんど機能がわかっていない分子やリンクRNA・天然変性蛋白 (IDP) などの非典型的な作動原理を持つものが多く含まれます。
私たちの研究室では、そのような「全く新規の」はたらきをもつ分子の機能もキャッチするため、方法論にしばりを設けず、自由な発想や実験データを尊重するアプローチで研究を進めています。
細胞若年性 Cellular Juvenescence
「若年性」は多細胞からなる器官や動物個体に備わる性質ですが、その元となる生命現象は細胞のレベルで起きていると考えられます。子どもを構成する細胞と、大人を形作る細胞は性質が異なります。子どもの細胞は一般に「増殖性」が高く、より高度に機能特化した細胞の変化する「分化」の潜在性をより高くもちます。また脳神経による学習で見られるように「可塑性」を発揮してより高度な情報を保持できるようになります。ケガの治りが早いことからわかるように高い「回復性」があり、また自然な老化を食い止めるための「老化抵抗性」も備わっていると実験結果に基づいて考えています。これらの小児の細胞に特有の性質を「細胞若年性」"Cellular juvenescence"と呼んでいます。
私たちが特定した若年性遺伝子のはたらきを阻害すると細胞は若年性を失い、早期老化を呈することを見出しています。
若年性遺伝子 JAG
若年性遺伝子 (JAG, ジャグ) は小児期に高発現する遺伝子としてマウスで特定された一群の遺伝子ですが、ヒトでも保存されています。ヒトの健常な小児の遺伝子発現プロファイル (トランスクリプトームと呼ばれます) は不明な部分が大きいですが、例外的に脳は詳細なトランスクリプトーム解析が完了しており、生物種横断的な比較が可能になっています。脳トランスクリプトームにおける種間保存性は高く、若年性の分子機構が生命にとって普遍的に重要であることが示唆されます。
若年性リンクRNA JALNC
「遺伝子」は、細胞がもつ「核」の内腔に保護されたゲノムDNAに書かれた遺伝子のはたらきの機能単位です。ゲノムDNAはA, C, G, Tのたった4つの文字で書かれています。 機能がある部分もなさそうな部分も、その点は変わりません。典型的な遺伝子は、「転写」と呼ばれるプロセスでRNAに写し取られます。このRNAも4つの文字の情報を保持します。「スプライシング」と呼ばれる不要部分の切り抜きを経て、RNAは蛋白質 (たんぱく質) に読み変えられます (「翻訳」と呼ばれます)。蛋白質は酵素として生物活性をもっていたり、細胞を作る骨組みとしてはたらきます。
機能がある部分もなさそうな部分も、その点は変わりません。典型的な遺伝子は、「転写」と呼ばれるプロセスでRNAに写し取られます。このRNAも4つの文字の情報を保持します。「スプライシング」と呼ばれる不要部分の切り抜きを経て、RNAは蛋白質 (たんぱく質) に読み変えられます (「翻訳」と呼ばれます)。蛋白質は酵素として生物活性をもっていたり、細胞を作る骨組みとしてはたらきます。
ところが、「翻訳」と呼ばれる蛋白質への読み変えをせずに、RNAのままで働く遺伝子が少なくないことがわかってきました。そのような蛋白質をコードしないRNAのうち比較的長いものをロング・ノンコーディングRNA (long noncoding RNA = lncRNA, リンクRNA) と呼びます。RNAは分子の立体構造が極めて柔軟でダイナミックなので、作動原理に不明な点が多いです。
小児期に高発現するリンクRNAを若年性リンクRNA (juvenility-associated lncRNA, JALNC, ジャリンク) と呼び、報告を行いました (Tano et al., 2019)。JALNCには機能未知なものが多く含まれますが、その中でもヒトとマウスなど生物種間の進化的な保存性が高い「Gm14230」とナンバリングされたリンクRNAに生物学的な重要な働きがあることを突き止めました。Gm14230は「RNAエディティング (RNA editing)」と呼ばれる修飾を受けます。RNAに転写されたあと、A (アデノシン) の文字が I (イノシン) に書き換えられてしまうのです。Gm14230のRNA編集は年齢依存的で、加齢に伴い増加します。また、Gm14230を減少させると細胞若年性が失われ、細胞老化が惹起されます。
年齢依存的オルタナティブ・スプライシング ADAS
遺伝子が機能するプロセスで、転写のあとに「スプライシング」を受けます。スプライシングにより、RNAの不要な部分が切り捨てられ、残った部分のみがつなぎ合わされ、翻訳にまわされます。なぜこのような不要な部分をゲノムDNAに置いておくのでしょうか。それは、切り捨てる部分を変えることで、はたらきの異なる蛋白分子を作り出すためです。「スプライシング」というステップがあることで、ただ1つのゲノムDNAから多くの種類のRNAやタンパク質を合成することができるのです。スプライシングのパターンが変化することを「オルタナティブ・スプライシング」といいます。臓器の違いによってもオルタナティブ・スプライシングが幅広く観察されます。なぜここまで複雑な仕組みをもつ必要があるのか、私の知る限り、理解されていません。
では、小児期には、「オルタナティブ・スプライシング」が起きるのでしょうか? 胎児期には成人期と異なるスプライシングが起こることが良く知られていました。しかし、生後の成長過程でスプライシングのパターンが変化するかどうかは知られていませんでした。私たちはマウスでこの点を詳細に検討し、脳・心臓・肝臓など幅広い臓器で広範な遺伝子において小児期に特有なタイプのオルタナティブスプライシングが実行されることを明らかにしました (Kadota et al., 2020)。これらを「年齢依存的オルタナティブ・スプライシング」(Age-Dependent Alternative Splicing, ADAS, エイダス) として報告しました。
ADASにより、同じ遺伝子であっても、大人と子どもで違うはたらきの分子が生成されます。一例として翻訳を抑制する機能のあるEIF4A2分子は、小児型のスプライシングを受けると翻訳を抑制するドメインを欠失します。翻訳を抑制することは、おおざっぱに言うと体を作ることに抑制的に作用するので、そのようなはたらきが「成長の活発な」小児では抑えられていることは理にかなっています。
ADASの実行に必須な分子の1つとしてSRSF7を同定しました。SRSF7は若年性遺伝子 (JAG) の1つです。SRSF7はスプライシング因子の1つで、後述する天然変性タンパク質 (intrinsically disordered protein, IDP) の1つです。スプライシングというRNAの切離とつなぎ合わせを遂行する1文字もずれてはいけない繊細な反応は、スプライソソーム (spliceosome) と呼ばれる特殊な微小コンパートメントで実行されます。
細胞競合は多細胞生物が細胞均一性を保つために実行する、進化的に保存された機構です。生物は極めて精巧にできた細胞分裂機構によって細胞の数を増やすことで生長します。それぞれの生物種が特有にもつ規定のサイズにいたるまで成長して、そこで未知の機構によりブレーキがかかり、サイズの増大を停止させます。ヒトでは37兆個と報告されている多くの細胞が生み出される過程で、多くのばらつきが生じると想像されます。分裂の過程でゲノムDNAの複製エラーが生じて「がん細胞」に近い状態のものが生じるかも知れません。また、それ以外の理由で、正常な臓器形成に携わるには支障のある細胞が生まれることもあると思われます。細胞競合は、そのようなその「場」に不適切な細胞を除去する機構としてはたらきます。 キイロショウジョウバエの研究では、遺伝子の変異をもった細胞が、隣接する正常な細胞によって細胞死 (アポトーシス) に導かれることが明らかになっています。異常な細胞が増殖して臓器の形成や個体の生存をおびやかすのを未然に防ぐのです。異常な細胞は弱っているものばかりでなく、ときによってがん細胞のように旺盛に増殖しますので、これに打ち勝って排除するにはかなりのエネルギーを要すると思われます。さらに、マウスでは、例えば大腸の上皮細胞層に生じた癌細胞が "apical extrusion" (腸の管腔内への押し出し・追放) と呼ばれる現象で排除されることがわかっています。
キイロショウジョウバエの研究では、遺伝子の変異をもった細胞が、隣接する正常な細胞によって細胞死 (アポトーシス) に導かれることが明らかになっています。異常な細胞が増殖して臓器の形成や個体の生存をおびやかすのを未然に防ぐのです。異常な細胞は弱っているものばかりでなく、ときによってがん細胞のように旺盛に増殖しますので、これに打ち勝って排除するにはかなりのエネルギーを要すると思われます。さらに、マウスでは、例えば大腸の上皮細胞層に生じた癌細胞が "apical extrusion" (腸の管腔内への押し出し・追放) と呼ばれる現象で排除されることがわかっています。
私たちの研究でも、細胞競合は小児の臓器成長において細胞の均一性を保つために重要な仕組みと考えており、先天異常症の病態解明や治療への応用を視野に入れて研究を進めています。
細胞内マクロ構造体 Cytoophidia
細胞の構造やはたらきは、現代科学をもってしても、ほとんどわかっていません。オルガネラとは、細胞内小器官と訳され、核・ミトコンドリア・小胞体・リボソームなど多くが知られています。それらはどうやって構築されるのか、ほとんどわかっていません。また、これらオルガネラのように常に存在するもの以外にも、細胞内の構造体がたくさん知られています。これから発見されたり重要性が認識されるようになるものが多数ありそうです。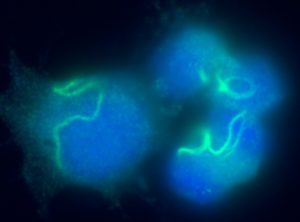
私たちは2021年にTBC1D24分子が、「サイトオーフィディア」と総称される構造体を作ることを報告しました。「サイト」は細胞、「オーフィディア」はギリシャ語でヘビのことで、その名の通り、細胞内でヘビのようにうねりのある繊維構造を作ります。これはグルタミン代謝の阻害などで消失するのですが、どのような原理で重合したり解離したりするのか、まだわかりません。なぜ重合してマクロ構造を取るのかも、まだわかっていません。まだまだ研究が必要です。
細胞内マクロ構造体
細胞内コンパートメント形成 Phase separation
天然変性タンパク質 (intrinsically disordered protein, IDP) とは、安定した立体構造を取らない領域をもつ蛋白質の一群で、その中には集合体を形成して周りの「相」と区別される相を形成するものがあります。その集合体は"biomolecular condensate"と呼ばれます。これらは「膜」をもちません。多くの細胞内構造体は生体膜で区画化されますが、膜を持つことなく、細胞が多くの場所で相分離によって区画化されていることがわかってきました。相分離によって区画化された細胞内構造で良く知られたものには、核小体・パラスペックル・中心体・P顆粒・ストレス顆粒などがあります。
私たちはBEX1と呼ばれる若年性遺伝子が天然変性タンパク質をコードし、BEX1分子は一次線毛の基部 (基底小体、 "Basal body"と呼ばれます) に集積し、チューブリン重合反応を促進する微小区画を形成することを報告しました (Hibino et al., BMC Biology, 2022)。
細胞の中は分子で充満しています。込み合った細胞の中で数多くの反応が「混線」することなく進行できる理由はわかっていません。細胞内の「区画化」がどのような役割をもつか、今まさにその研究が進行中です。
